Example
Extraído de Deodhar et al, 2021.
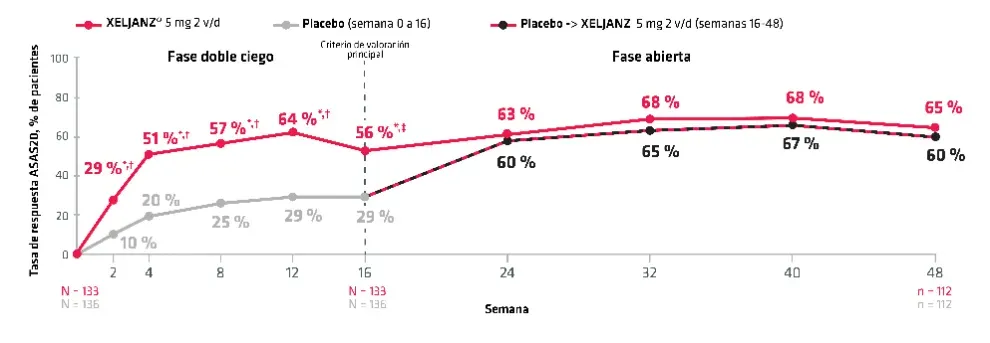
Se compone de 4 dominios (cada uno con una puntuación del 0 al 10): valoración global de la enferemedad por parte de los pacientes, lumbalgia total, función e inflamación. Se definió "respuesta ASAS20" como una mejora ≥20% y ≥1 unidad en al menos 3 dominios y ausencia de empeoramiento ≥20% y ≥1 unidad en el dominio restante.3,4
Extraído de Deodhar et al, 2021.
Se compone de 4 dominios (cada uno con una puntuación del 0 al 10): valoración global de la enfermedad por parte de los pacientes, lumbalgia total, función e inflamación. Se definió “respuesta ASAS40” como una mejora ≥40 % y ≥2 unidades en al menos 3 dominios y ausencia de empeoramiento en el dominio restante.4
Estudio en fase III aleatorizado de 48 semanas de duración (una fase doble ciego de 16 semanas seguida de una fase abierta de 32 semanas) en el que se incluyó a 269 pacientes adultos con EA activa y respuesta inadecuada a ≥ 2 AINE. La aleatorización se estratificó por la historia de tratamiento con bFARME en los pacientes con respuesta inadecuada a ≤ 2 iFNT o que habían usado con anterioridad bFARME (iFNT o no) sin RI. En el momento inicial, no habían usado bFARME 207 pacientes y 62 eran iFNT-RI o habían usado bFARME con anterioridad (sin RI). Se permitían los AINE/inhibidores de COX-2, el MTX, la SSZ o los corticoesteroides por vía oral si la dosis de los pacientes era estable en el momento inicial. En el caso de los pacientes que tomaban XELJANZ®, la media de edad era de 42,2 años (40 años, en el caso del placebo) y la mayoría de los pacientes eran hombres (87,2 % en el caso de XELJANZ 5 mg 2 v/d, 79,4 % en el caso del placebo). La duración media de la enfermedad desde el inicio de los síntomas de los pacientes que tomaban XELJANZ en el ensayo era de 14,2 años (12,9 años en el caso del placebo), la duración de la enfermedad de EA desde el diagnóstico era: media de 8,9 años (6,8 en el caso del placebo) y la media de la puntuación BASDAI en el momento inicial era: 6,4 (6,5 en el caso del placebo).
El criterio de valoración principal era evaluar la proporción de pacientes que alcanzaban respuesta ASAS20 en la semana 16. Para el control por error de tipo I en el nivel del 5 % para los criterios de valoración principal y algunos secundarios se probaron en secuencias jerárquicas 4 familias de criterios de valoración de la eficacia, con un enfoque escalonado. En la primera familia, los criterios de valoración global con control por error de tipo I en la semana 16 incluían: respuestas ASAS20 y ASAS40; ΔASDAS(CRP); puntuación ΔPCRas, ΔCdVEA, puntuación ΔSF-36v2 PCS, ΔBASMI y la puntuación ΔFACIT-F total. Al alcanzar significación estadística para la respuesta ASAS20 en la semana 16, la segunda familia incluía los componentes ΔASAS en la semana 16 e incluía pruebas de ΔPtGA, Δ de lumbalgia total, ΔBASFI y Δ de la rigidez matutina (inflamación). Las familias tercera (respuesta ASAS20 en el tiempo) y cuarta (respuesta ASAS40 en el tiempo) se pusieron a prueba en la secuencia siguiente: semanas 16, 12, 8, 4 y 2. En cada familia, la significación estadística únicamente se declaraba si el criterio de valoración (o momento) anterior en la secuencia cumplía los requisitos para constituir significación. La imputación “sin respuesta” se aplicaba a los datos faltantes para las tasas de respuesta ASAS.
Puede obtener más información sobre el perfil de seguridad de XELJANZ en la EA
Aprenda más sobre la posología de XELJANZ
Aquí puede obtener más información sobre iJAK con la mayor experiencia en el mercado en la AR, la APs, la EA, la CU y la AIJ